- May -akda Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:41.
- Huling binago 2025-01-22 17:11.
Kaya, kami kalkulahin ito sa pamamagitan ng pagkuha ng weighted misa ng bawat isa sa mga isotopes at pagdaragdag ng mga ito nang sama-sama. Kaya, para sa una misa , magpaparami tayo ng 0.50% ng 84 (amu - atomic mass units) = 0.042 amu, at idagdag ito sa 9.9% ng 86 amu = 8.51 amu, at iba pa.
Kasunod nito, maaari ring magtanong, paano mo kinakalkula ang average na atomic mass?
Pagkalkula ng Average na Atomic Mass Ang average na atomic mass ng isang elemento ay ang kabuuan ng masa ng mga isotopes nito, bawat isa ay pinarami ng natural na kasaganaan nito (ang decimal na nauugnay sa porsyento ng mga atomo ng elementong iyon na nasa isang ibinigay na isotope). Average na atomic mass = f1M1 + f2M2 +…
Alamin din, anong tatlong uri ng impormasyon ang kailangan upang makalkula ang isang average na atomic mass? Ang Bilang ng Isotopes na Umiiral Para sa Elemento. Ang Atomic Numero Para sa Elemento. Ang Porsiytong Kasaganaan Ng Bawat Isotope.
Maaari ring magtanong, anong halaga ang pinakamalapit sa atomic mass ng strontium?
Strontium . Sa ulat nito noong 1961, inirerekomenda ng Komisyon si Ar(Sr) = 87.62 batay sa misa -spectrometric na pagpapasiya ng Nier. Ito halaga ay binago sa Ar(Sr) = 87.62(1) noong 1969 at nananatili itong hindi nagbabago mula noon.
Ano ang may masa na 1 amu?
Ang isang atomic mass unit (sinasagisag na AMU o amu) ay tinukoy bilang tiyak na 1/12 ng masa ng isang atom ng carbon-12. Ang carbon-12 (C-12) atom ay may anim mga proton at anim mga neutron sa nucleus nito. Sa hindi tumpak na mga termino, isang AMU ang average ng proton rest mass at ang neutron rest mass.
Inirerekumendang:
Ano ang average na atomic mass ng isang atom?

Ang average na atomic mass ng isang elemento ay ang kabuuan ng mga masa ng mga isotopes nito, bawat isa ay pinarami ng natural na kasaganaan nito (ang decimal na nauugnay sa porsyento ng mga atom ng elementong iyon na nasa isang ibinigay na isotope). Average na atomic mass = f1M1 + f2M2 +
Paano natutukoy ang average na atomic mass sa periodic table?
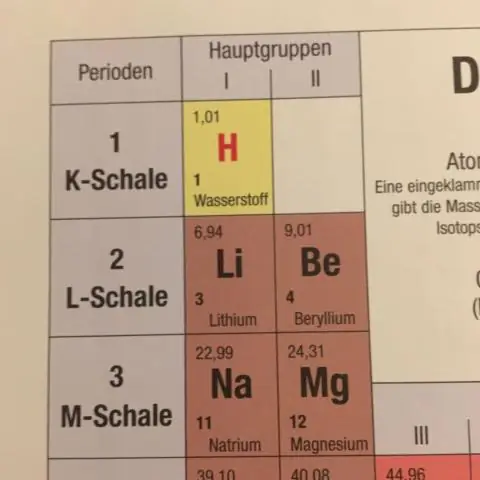
Ang average na atomic mass para sa isang elemento ay kinakalkula sa pamamagitan ng pagbubuod ng mga masa ng isotopes ng elemento, bawat isa ay pinarami ng natural na kasaganaan nito sa Earth. Kapag gumagawa ng anumang mga kalkulasyon ng masa na kinasasangkutan ng mga elemento o compound, palaging gumamit ng average na atomic mass, na makikita sa periodic table
Paano mo kinakalkula ang atomic mass ng boron?
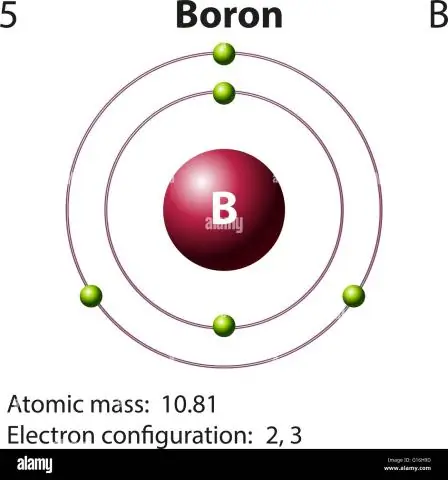
Para sa boron, magiging ganito ang equation na ito: 5 protons + 5 neutrons = 10 atomic mass units (AMU) o, para sa mas karaniwang nangyayaring boron isotope (approx. 5 protons + 6 neutrons = 11 AMU
Paano mo kinakalkula ang mga problema sa pagsasanay ng atomic mass?
VIDEO Pagkatapos, paano mo malulutas ang mga problema sa atomic mass? Upang kalkulahin ang atomic mass ng isang atom ng isang elemento, idagdag ang misa ng mga proton at neutron. Halimbawa: Hanapin ang atomic mass ng isang isotope ng carbon na mayroong 7 neutron.
Bakit ang periodic table ay nakaayos ayon sa atomic number at hindi atomic mass?

Bakit ang Periodic Table ay nakaayos ayon sa atomic number at hindi atomic mass? Ang atomic number ay ang bilang ng mga proton sa nucleus ng bawat atom ng elemento. Ang numerong iyon ay natatangi sa bawat elemento. Ang masa ng atom ay tinutukoy ng bilang ng mga proton at neutron na pinagsama
