
Talaan ng mga Nilalaman:
- May -akda Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:41.
- Huling binago 2025-01-22 17:12.
Transcript
- Hatiin ang bawat % sa atomic misa ng elemento.
- Hatiin ang bawat isa sa mga sagot na iyon ayon sa pinakamaliit.
- Ayusin ang mga numerong ito sa kanilang pinakamababang whole-number ratio.
Pagkatapos, paano mo mahahanap ang empirical formula na may mga porsyento?
ang masa ng bawat elemento = ang porsyento na ibinigay. I-convert ang masa ng bawat elemento sa mga moles gamit ang molar mass mula sa periodic table. Hatiin ang bawat halaga ng nunal sa pinakamaliit na bilang ng mga mole na nakalkula. Bilugan sa pinakamalapit na buong numero.
Kasunod nito, ang tanong ay, paano mo mahahanap ang empirical formula mula sa combustion? Kalkulahin ang empirikal na pormula ng compound mula sa gramo ng carbon, hydrogen, at oxygen. Kalkulahin ang pormula misa para sa empirikal na pormula at hatiin ang ibinigay na molecular mass sa empirikal na pormula masa para makuha n. I-multiply ang bawat isa sa mga subscript sa empirikal na pormula sa pamamagitan ng n upang makuha ang molekular pormula.
Katulad nito, maaari mong itanong, paano mo matutukoy ang empirical formula?
Pagkalkula ng isang Empirical Formula
- Hakbang 1: Kunin ang masa ng bawat elemento na nasa gramo. Elemento % = masa sa g = m.
- Hakbang 2: Tukuyin ang bilang ng mga moles ng bawat uri ng atom na naroroon.
- Hakbang 3: Hatiin ang bilang ng mga nunal ng bawat elemento sa pinakamaliit na bilang ng mga nunal.
- Hakbang 4: I-convert ang mga numero sa buong numero.
Ano ang empirical formula para sa caffeine?
Ito ang empirikal na pormula . Problema #4: Caffeine ay may sumusunod na porsyentong komposisyon: carbon 49.48%, hydrogen 5.19%, oxygen 16.48% at nitrogen 28.85%.
Empirical at Molekular Mga formula.
| carbon: | 8 |
|---|---|
| oxygen: | 2 |
| nitrogen: | 4 |
Inirerekumendang:
Paano mo mahahanap ang empirical formula na may mga porsyento?

Transcript Hatiin ang bawat % sa atomic mass ng elemento. Hatiin ang bawat isa sa mga sagot na iyon ayon sa pinakamaliit. Ayusin ang mga numerong ito sa kanilang pinakamababang whole-number ratio
Paano mo mahahanap ang tinatayang porsyento gamit ang empirical rule?

Ang paghahanap ng lugar sa ilalim ng curve mula sa x = 9 hanggang x = 13. Ang Empirical Rule o 68-95-99.7% Rule ay nagbibigay ng tinatayang porsyento ng data na nasa loob ng isang standard deviation (68%), dalawang standard deviations (95%) , at tatlong standard deviations (99.7%) ng mean
Paano ka sumulat ng mga formula gamit ang Criss Cross method?
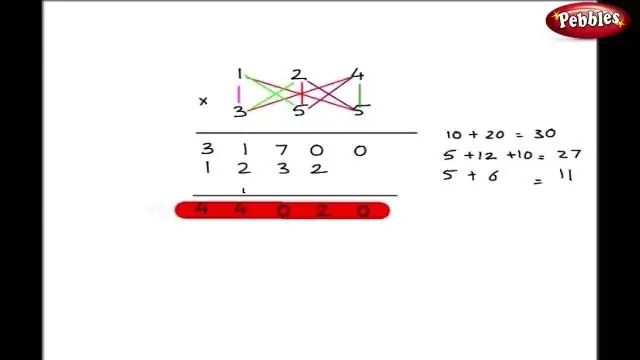
Ang isang alternatibong paraan sa pagsulat ng tamang formula para sa isang ionic compound ay ang paggamit ng crisscross method. Sa pamamaraang ito, ang numerical na halaga ng bawat isa sa mga singil ng ion ay tinatawid upang maging subscript ng isa pang ion. Ang mga palatandaan ng mga singil ay ibinaba. Isulat ang formula para sa lead (IV) oxide
Ano ang empirical formula at molecular formula?
Ang mga molekular na formula ay nagsasabi sa iyo kung gaano karaming mga atom ng bawat elemento ang nasa isang tambalan, at ang mga empirikal na formula ay nagsasabi sa iyo ng pinakasimple o pinakabawas na ratio ng mga elemento sa isang tambalan. Kung ang molecular formula ng isang compound ay hindi na mababawasan, kung gayon ang empirical formula ay kapareho ng molecular formula
Paano ka sumulat ng mga formula para sa binary ionic compound?
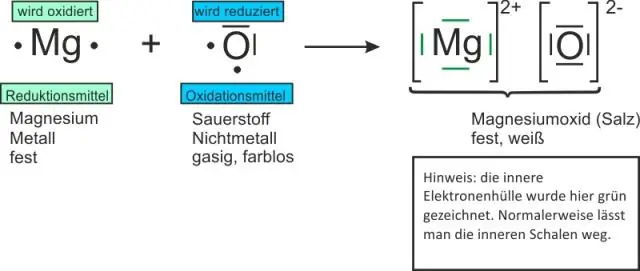
Ang mga formula para sa binary compound ay nagsisimula sa metal na sinusundan ng nonmetal. Ang mga positibo at negatibong singil ay dapat kanselahin ang isa't isa. Ang mga formula ng ionic compound ay isinulat gamit ang pinakamababang ratio ng mga ion
