
- May -akda Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:41.
- Huling binago 2025-01-22 17:11.
Ang chlorine isotope na may 18 neutron ay may kasaganaan na 0.7577 at isang mass number na 35 amu. Upang kalkulahin ang karaniwan atomic mass, i-multiply ang fraction sa mass number para sa bawat isa isotope , pagkatapos ay idagdag ang mga ito nang sama-sama.
Katulad nito, ano ang weighted average ng lahat ng isotopes ng isang elemento?
Gamit ang masa ng iba't ibang isotopes at kung gaano kasagana ang bawat isa isotope ay, mahahanap natin ang karaniwan masa ng mga atomo ng isang elemento . Ang atomic mass ng isang elemento ay ang weighted average masa ng mga atom sa isang natural na nagaganap na sample ng elemento . Ang atomic mass ay karaniwang iniuulat sa atomic mass units.
ano ang may masa na 1 amu? Ang isang atomic mass unit (sinasagisag na AMU o amu) ay tinukoy bilang tiyak na 1/12 ng masa ng isang atom ng carbon-12. Ang carbon-12 (C-12) atom ay may anim mga proton at anim mga neutron sa nucleus nito. Sa hindi tumpak na mga termino, isang AMU ang average ng proton rest mass at ang neutron rest mass.
Pangalawa, paano mo kinakalkula ang porsyento ng kasaganaan gamit ang atomic mass?
Baguhin ang bawat isa porsyentong kasaganaan sa decimal na anyo sa pamamagitan ng paghahati sa 100. I-multiply ang value na ito sa atomic mass ng isotope na iyon. Magdagdag ng sama-sama para sa bawat isotope upang makuha ang average atomic mass.
Ano ang pagkakaiba sa pagitan ng atomic mass at atomic weight?
Mass ng atom (ma) ay ang misa ng atom . Isang single atom ay may nakatakdang bilang ng mga proton at neutron, kaya ang misa ay malinaw (hindi magbabago) at ang kabuuan ng bilang ng mga proton at neutron sa atom . Konting bigat ay isang weighted average ng misa ng lahat ng mga atomo ng isang elemento, batay sa kasaganaan ng isotopes.
Inirerekumendang:
Paano mo mahahanap ang average na bilis na may dalawang bilis?
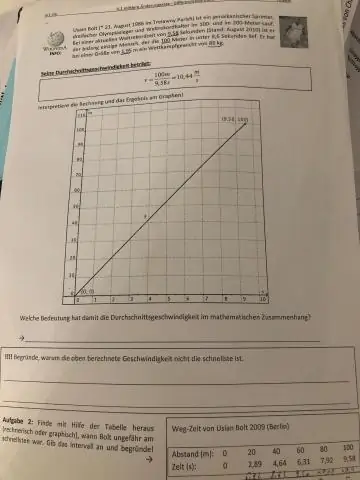
Ang kabuuan ng inisyal at huling bilis ay hinati sa 2 upang mahanap ang average. Ang average na velocity calculator ay gumagamit ng formula na nagpapakita ng average na velocity (v) na katumbas ng kabuuan ng final velocity (v) at ang initial velocity (u), na hinati sa 2
Paano ka gumawa ng weighted average sa isang pivot table?

Mga Weighted Average sa isang PivotTable I-click ang pababang arrow sa tabi ng salitang PivotTable sa kaliwang bahagi ng toolbar ng PivotTable. Pumili ng Mga Formula | Mga Nakalkulang Patlang. Sa kahon ng Pangalan, maglagay ng pangalan para sa iyong bagong field. Sa kahon ng Formula, ilagay ang formula na gusto mong gamitin para sa iyong weighted average, gaya ng =WeightedValue/Weight. I-click ang OK
Ano ang weighted average na masa?

Ang atomic mass ng isang elemento ay ang weighted average ng mga masa ng isotopes ng isang elemento. Ang atomic mass ng isang elemento ay maaaring kalkulahin kung ang mga kamag-anak na kasaganaan ng mga natural na nagaganap na isotopes ng elemento at ang masa ng mga isotopes na iyon ay kilala
Paano mo mahahanap ang average gamit ang Excel?
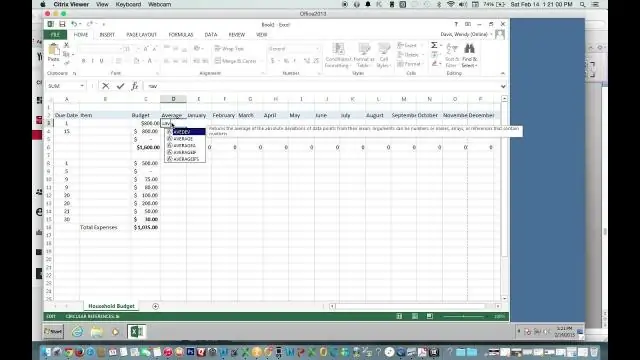
Gamitin ang AutoSum upang mabilis na mahanap ang average na Mag-click sa isang cell sa ibaba ng column o sa kanan ng row ng mga numero kung saan mo gustong hanapin ang average. Sa tab na HOME, i-click ang arrow sa tabi ng AutoSum > Average, at pagkatapos ay pindutin ang Enter
Paano mo mahahanap ang average na bilis sa isang graph ng bilis kumpara sa oras?

Ang lugar sa ilalim ng velocity/time curve ay ang kabuuang displacement. Kung hahatiin mo iyon sa pagbabago ng oras, makukuha mo ang average na bilis. Ang bilis ay ang vector form ng bilis. Kung ang tulin ay palaging hindi negatibo, ang average na bilis at average na bilis ay pareho
